سخنی چند با کمیته ملی اخلاق و سازمان غذا و داروی وزارت بهداشت...
نقدی بر مجوز اضطراری واکسن فخرا و تولید و انجام فاز بالینی واکسن نورا

صدور مجوز اضطراری برای واکسن فخرا و سایر مجوزها برای واکسنهای داخلی و از همه مهمتر اشکالات علمی در روند تولید و ارزیابی واکسن نورا که به شرح ذیل آمده، اثبات این است که وزارت بهداشت و کمیته ملی اخلاق و سازمان غذا و دارو وظایف خودشان را نسبت به تضمین سلامت بهداشت جامعه بهخوبی انجام نمیدهند.
عصر ایران- طی روزهای گذشته روند مطالعه، تحقیق و خصوصاً فازهای آزمایشی-بالینی چند واکسن کرونا در ایران، صدور مجوزهای اضطراری از سوی وزارت بهداشت و آموزش عالی و همچنین "حاکمیت تعارض منافع در بررسی فاز بالینی واکسنها، مورد نقد جامعه علمی کشور، پزشکان، محققان و متخصصان قرار گرفته است. بدیهی است نقد علمی و مستدل در هر پروژه عام المنفعهای که از امکانات و اعتبارات ملی استفاده میکنند، به کاهش خطاها و تصحیح مسیرها میانجامد. از این منظر مقاله دکتر سید محمود ابراهیمی، متخصص درزمینهٔ ویروس و واکسن را که برای عصر ایران ارسال شده، در ادامه می خوانید.
بدیهی است عصر ایران از پاسخ مستدل افراد، موسسات، نهادها و شرکتهایی که نامشان در این گزارش ذکر شده استقبال می کند.
خلاصه: با اینکه وزارت بهداشت مدعی مواجه با سیل واکسن است، اقدام به صدور مجوز اضطراری برای واکسن فخرا کرده است. همچنین در بحث تولید واکسن نورا اقدامات سئوال برانگیز علمی وجود دارد که بنابه فرمایش مقام معظم رهبری نیاز به شفاف سازی وفق مستندات است. مضافا اینکه دانشگاه بقیه الله به اعتبار نام سپاه با نظام ولایی و صیانت از حقوق و سلامت مردم عجین است و نباید دست به کارهایی زند که بهانه طعنه از سپاه را فراهم نماید.
متاسفانه، در شرایط بحرانی کنونی تنها چیزی که غالب است بی توجهی به سلامت مردم و عدم پاسخگو بودن وزارت بهداشت در صدور مجوزات بالینی است. هر فردی عامی هم اگر نگاهی اجمالی به عنوان پروژه فاز بالینی واکسن نورا بیندازد، به این سئوال میرسد که واکسنهای پاستور و سیناژن و رازی و نورا هر چهار تا مشابه و از واکسنهای نوترکیب هستند. پس چرا باید واکسن نورا سه تزریق با غلظت ۱۲۰ میکرو گرم داشته باشد و سایر واکسنهای مشابه دو تزریق با نهایت غلظت ۲۰ تا ۲۵ میکروگرم؟ پاسخ به این سئوال مهم در گزارش علمی ذیل آمده است.
از طرفی، رئیس دانشگاه بقیه الله آشکارا تن به تعارض منافع داده و خودشان هم طراح و سازنده واکسن نورا هستند و هم انجام دهنده فازهای بالینی آن؛ این اقدامی است بی سابقه که شبهات را نسبت به نتایج پیشْ بالینی و بالینی واکسن نورا دو چندان کرده است.
نقدی بر مجوز اضطراری واکسن فخرا و تولید و انجام فاز بالینی واکسن نورا
دکتر سید محمود ابراهیمی*- از بدو شیوع کووید ۱۹، ساخت واکسن علیه این ویروس جزء اولویتها و دستور کار وزارت بهداشت قرار گرفت. در این راستا، بنا به گفته دکتر قانعی دبیر ستاد توسعه زیستفناوری، مجموع ۲۱ واحد اعم از مؤسسات مختلف و شرکتهای دانشبنیان موضوع خودکفایی در تولید واکسن کووید-۱۹ را از همان روزها و هفتههای ابتدایی، آغاز کرده و از آنها فقط ۱۴ شرکت در پلتفرمهای مختلف تولیدی توانسته به سطحی از تولید برسد که متقاضی صدور پروانه تولید واکسن از سازمان غذا و دارو شود.
غیر از خط تولید واکسن روسی در ایران، از این شرکتهای متقاضی داخلی، تاکنون ۶ شرکت تولیدی مبتنی بر ویروس کشته (فخرا و برکت) و پروتئین نوترکیب (رازی، پاستور، سیناژن و بقیهالله) موفق به اخذ مجوز بالینی شدهاند که اکنون در فاز مختلف مطالعات بالینی قرار دارند.
از بین الگوهای مختلف واکسنهای نوترکیب که عموماً منشأ یوکاریوتی دارد، فقط دانشگاه بقیهالله بوده است که از الگوی غیرمتعارف پروکاریوتی (باکتریایی) برای تولید پروتئین نوترکیب شدیداً قندی اسپایک کرونا استفاده کرده است. مضافاً اینکه هر دوز مصرفی واکسن نورا با غلظت 120 میکروگرم در مطالعات فاز بالینی آن گزارششده است که این مقدار نامتعارف و عجیب از پروتئین نوترکیب در همراهی با ادجوانت که عموماً هم در ایران آلوم است علیرغم غیر رقابتی و غیر اقتصادی بودن آن میتواند با عارضه تحمل ایمنی همراه باشد.
اما قابل تأسف تر، اظهارات غیرمتعارف اخیر فرمانده ستاد عملیات مقابله با کرونا آقای دکتر زالی است که این پزشک متخصص و در رتبه استاد دانشگاه طی مصاحبهای بیان داشتهاند که واکسن نورا با چنین غلظتی برای گروه سنی کودکان اثربخشی و ایمنیزایی داشته است. این ادعای غیر مستند در صورتی است که واکسن نورا هنوز مجوز فاز بالینی دوم و سوم که معطوف به ارزیابی ایمنیزایی و اثربخشی واکسن است را اخذ ننموده است!
یا مثلاً صدور مجوز اضطراری برای واکسن فخرا یک اقدامی سیاسی و تبلیغاتی است. این در صورتی است که تولید یک اقدامی صرفاً علمی و اقتصادی است و وزارت بهداشت مسئول تضمین سلامت جامعه است و نباید اجازه دهد که سلامت جامعه ملعبه تبلیغات قرار گیرد. چراکه صدور مجوزهای اضطراری قاعده و شرایط خاص خود را داراست و در شرایطی که وزارت بهداشت مدعی است که امروزه با سیل واکسن مواجه است و سابقه صدور مجوز اضطراری برای برکت و پاستور دارد، چه اضطراری احساس شد که بدون انجام فاز بالینی سوم مجدداً مبادرت به صدور مجوز اضطراری برای واکسن فخرا نماید؟
همچنین از بین این شرکتهای مدعی یا متقاضی تولید واکسن کرونا، فقط انستیتو رازی و پاستور است که سابقه طولانی در تولید واکسن را داراست. مثلاً سابقه تولیدی انستیتو رازی در تولید سرم و واکسن به حدود صدسال میرسد که بالغبر ۶۰ نوع مواد بیولوژی مختلف را تولید و صادر مینماید.
بقیه شرکتهای مدعی تولید واکسن کاملاً نوپا و فاقد شرایط علمی و تجربه کافی و حتی فاقد زیرساختی لازم و کافی جهت تولید واکسن هستند.
جالب اینجاست، بااینکه انستیتو پاستور سابقه تولید تعدادی محدود واکسن را داراست؛ یعنی کلیه زیرساختهای لازم اعم از فنی، علمی، اعتباری، امکانات و تجهیزات لازم جهت تولید را از قبل مهیا و بهینه نموده است؛ اما محققان انستیتو پاستور بجای اینکه خلاقیت و نبوغشان در تولید واکسن کرونا را در مکان تحقیقاتی و تولیدی انستیتو پاستور با زیرساختهای موجود پیاده کنند، سر از بنیاد برکت درآوردهاند. بهنحویکه این محققان اعزامی، فراهم آوری زیرساخت و راهاندازی خط تولید و حتی تولید واکسن در بنیاد برکت را باهم شروع کرده و درنهایت مدعی تولید واکسن کرونا و بومیسازی و کسب دانش فنی تولید واکسن کشته در ایران شدهاند.
این ادعا به بومیسازی و کسب دانش فنی در صورتی است که انستیتو رازی بالغبر سی سال است که سالیانه بالغبر سه میلیارد دوز واکسن کشتهشده آنفلوانزا و نیوکاسل و تب برفکی و سرخک را وارد بازارهای داخلی و خارجی میکند.
از آنطرف، انستیتو پاستور بیتوجه به نبوغ محققانش در تولید واکسن کشته که در بنیاد برکت به شکوفایی رسیده، خود به سمت وارد نمودن خط تولید واکسن نوترکیب کوبایی گرایش پیداکرده است. یعنی تفسیر این واقعه با هیچ قلمی قابلبیان نیست، جز چنگ زدن به جمله تاریخی مظفرالدین شاه که فرمودند «همهچیزمان؛ به همهچیزمان میآید»!
این پراکندهکاری در تولید واکسن کرونا و بیتوجهی به سرمایهگذاری و تمرکز بر دو انستیتوی باسابقه واکسنسازی «پاستور و بهویژه رازی» موردی است که انتقادات زیادی را به همراه داشته است. بهنحویکه اخیراً رئیس دانشگاه تهران آقای دکتر نیلی نیز بهصورت مستدل طی مصاحبهای انتقادات زیادی به این موازیکاری و پراکنده کاریها در تولید وارد نمودند.
موازی کاری ها و تقویت شرکتهای نوظهور و بیتجربه در امر واکسنسازی نهتنها سبب به هدر رفت میلیاردها بودجه گردید و پوپولیست گرایی در امر تولید را شکل داد. بلکه نه تولید صنعتی محقق شد، نه خودکفایی در امر تولید و نه زیرساختهای آنچنانی در راستای اینهمه سرمایهگذاریها شکل گرفت. حتی صنعت عظیم و مجموعهدار واکسنسازی را نیز در سطح کنسروسازی تنزل دادیم و با یکسری شعار و وعدهووعیدهای یکسری عامی و ناآشنا با صنعت واکسنسازی، برنامههای پیشگیری دولت که با تضمین سلامت جامعه عجین است را نیز به انحراف کشاندیم.
اگر واقعگرا باشیم باید بپذیریم که ساخت واکسن بهصرف انجام یک پروژه علمی نیست؛ بلکه تلفیقی است از تجربه و فن و دانش و بهکارگیری علوم مختلف، پتانسیلهای صنعتی کشور در تولید تجهیزات آزمایشگاهی، اقتصاد، سیاست و ... که متأسفانه تجمیع این شرایط از عهده شرکتهای دانشبنیان و سازمانهای نظامی و سیاسی و اجرایی خارج است.
همچنین برخلاف رویه تبلیغاتی وزارتین بهداشت و علوم باید بپذیریم که تولید علم نیز بهصرف تولید و انتشار مقاله نیست. تولید علم نیز به زیرساختهای فنی و اقتصادی و صنعتی و .... خاص خود نیاز دارد و باید در صنعت، زندگی مردم، اقتصاد و قدرت سیاسی جامعه نماد عینی و عملی پیدا کند.
همچنین برخلاف تصورات و تبلیغاتی که در نشریات جریان دارد، واکسنسازی معنایش ترکیب یک آنتیژن با یک ادجوانت و تزریق آن به حیوان مدل و تولید آنتیبادی نیست.
اعتبار و شناسنامه مؤسسات واکسنسازی مبتنی بر تجارب مکتسبه و زیرساختهای دانشی و صنعتی موجود است و این امتیازات مهم موردی نیست که یکساله و با یکسری شعار تجمیع شده باشد. در علم تولید واکسن، فرمولاسیون، پایدارسازی آنتیژن، فعالیت بیولوژی آنتیژن، دینامیک آنتیبادی، استفاده صحیح از ادجوانتهای مناسب و بررسی اثربخشی واکسن حاکم است که هرکدام از این موارد بسیار هزینهبردار و زمانبر است.
این در صورتی است که در ایران تحقیقات آنچنانی درزمینهٔ ادجوانت نیز وجود ندارد و تنها ادجوانتی که در ایران همراه با واکسنهای کشتهشده یا نوترکیب استفاده میشود، ادجوانت آلوم است. مثلاً کلیه واکسنهای کرونای تولیدی داخل ازجمله برکت و فخرا و نورا و .... از ادجوانت آلوم استفاده کردهاند. این در صورتی است که ادجوانت آلوم برای تولید واکسنهای باکتریایی یا سمومی که خنثیسازی آنها مبتنی بر مکانیسم آگلوتینشین یا خنثیسازی از طریق کمپلکسهای آنتیژن چند ظرفیتی- آنتیبادی پلی کلونال است کاربرد دارد نه ویروسهایی ناپایدار که خنثیسازی آن مبتنی بر آنتیبادی مختص یک اپی توپ با افنیتی بالا و تحریک سیستم ایمنی سلولی است.
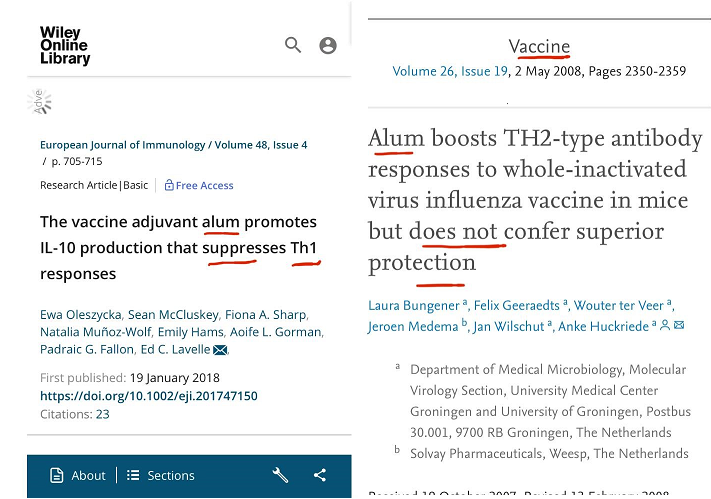
دراینباره مقالات تحلیلی معتبری وجود دارد و به خاطر بلاک کردن سیستم ایمنی سلولی (Th1) از میزان اثربخشی واکسنها میکاهد.
برای نمونه در این گزارش دو مقاله تحلیلی (تصاویر 1 و 2) که در دو ژورنال بسیار معتبر به چاپ رسیده است همین ادعا را به اثبات میرساند و در یکی از این مقالات واکسن کشتهشده آنفلوانزا در همراهی با آلوم و بدون آلوم در تست چالشی در حیوان مدل موردبررسی قرارگرفته است که نتیجتاً اثباتشده است که آلوم فقط تیتر آنتیبادی بدون اینکه خاصیتی داشته باشد بالابرده است و در عمل اثربخشی واکسن را نیز بشدت پایین آورده است.
تصاویر 1 و 2/ دو مقاله تحلیلی اشاره شده در بالا

وانگهی، واکسنسازی فقط یک مرکز تولیدی نیست. بلکه مجموعهای است زنجیرهای از تحقیق و توسعه، تولید، کنترل کیفیت و تضمین کیفیت و ترخیص.
در مراکز معتبر تولید واکسن یک مجموعه گسترده حیوانات آزمایشگاهی با امکانات مجهز و انواع حیوانات مدل استاندارد، شرایط نگهداری اصولی با کادر علمی متخصص و باتجربه وجود دارد که رابط بین مطالعات اولیه و فاز بالینیاند.
مثلاً، فقط دریکی از مراکز تولیدی واکسن بالغبر 200 متخصص خبره متخصص حیوانات آزمایشگاهی وجود دارد و اصل اثبات اثربخشی و پیش فرمولاسیون یک واکسن نیز از این مجموعه میگذرد.
این در صورتی است که در کل ایران یک مجموعه استاندارد نگهداری حیوانات آزمایشگاهی و ده نفر متخصص حیوانات آزمایشگاهی وجود ندارد.
در مراکز تولیدی استاندارد سیستم بزن دررویی حاکم نیست و رابط بین خط تولید و وزارت بهداشت و جامعه، مجموعهای است کاملاً تخصصی بنام "تضمین کیفیت" که این مجموعه مستقل از خط تولید بوده و پرسنل تخصصی آن مورد اعتماد و نمایندگان وزارت بهداشت هستند. مثلاً مجموعه تضمین کیفیت انستیتو رازی بالغبر ۲۳ آزمایشگاه تخصصی و بالغبر ۸۰ نیروی علمی کارآزموده دارد و اصل پاسخگویی و تضمین سلامت جامعه هم به عهده این مجموعه است و این مجموعه در همه حال و حتی تا سالیان بعد از مصرف واکسن مسئول پاسخگویی است.
این شرایط ویژه حاکم بر مراکز تولیدی باسابقه و استاندارد، موردی نیست که بهصورت ضربتی در یک مجموعه نوظهور فراهم و گردآوری شود. با این واقعیات اصولی و نظارتی حاکم بر مراکز تولید واکسن باید گفت که ادعای پیشفروش 120 میلیون دوز واکسن برکت یا تقاضای رئیس دانشگاه بقیهالله از وزارت بهداشت به پیش خرید واکسن نورا مؤید این است که جامعه ما هنوز با اصول ابتدایی تولید و تحقیق واکسن نیز آشنا نیست و این قابل تأسف است.
لذا با این شرایط باید گفت که اجازه مانور دادن به شرکتها و مؤسسات نوظهور و فاقد سابقه تجربه در امر واکسن کاری اشتباه بوده است که خسارات مادی و معنوی زیادی را بجای گذاشته است و به دلیل اینکه استفاده از چنین واکسنهایی با عملکردهای ناقص و غیرکارا میتواند با ایجاد فشار ایمنی حتی سبب موتاسیون در چنین ویروسهای ناپایداری شود.
پس میتوان گفت بجای پیشگیری، بهداشت جامعه را نیز با خطر بالقوه مواجه ساختهایم.
از طرفی، صدور مجوز بالینی برای چنین واکسنهایی مؤید این است که در ایران ایده اصولی و علمی و حتی زیرساختهای لازم برای تولید واکسن وجود ندارد. بلکه با یکسری تبلیغات و شعارگرایی حتی اجازه تمرکزگرایی و سرمایهگذاری بر روی مؤسسات باسابقه ازجمله موسسه رازی را نمیدهیم تا با شکلگیری یک موسسه استاندارد برای تهدیدات زیستمحیطی آتی آمادهباشیم.
با توضیحات بالا و نقد بر صدور مجوز اضطراری برای واکسن فخرا و سایر مجوزهای [...] برای واکسنهای داخلی و از همه مهمتر توجه به اشکالات علمی بر روند تولید و ارزیابی واکسن نورا که به شرح ذیل آمده، اثبات این است که وزارت بهداشت و کمیته ملی اخلاق و سازمان غذا و دارو وظایف خودشان نسبت به تضمین سلامت بهداشت جامعه بهخوبی انجام نمیدهند.
با توضیحات بالا و نقد بر صدور مجوز اضطراری برای واکسن فخرا و سایر مجوزهای [...] برای واکسنهای داخلی و از همه مهمتر توجه به اشکالات علمی بر روند تولید و ارزیابی واکسن نورا که به شرح ذیل آمده، اثبات این است که وزارت بهداشت و کمیته ملی اخلاق و سازمان غذا و دارو وظایف خودشان نسبت به تضمین سلامت بهداشت جامعه بهخوبی انجام نمیدهند.
اشکالات بنیادی واکسن نورا و حاکمیت تعارض منافع در بررسی فاز بالینی آن:
نظر به اینکه پروتئین اسپایک کرونا شدیداً قندی است که مولکولهای قندی آن در همراهی با پروتئینهای چاپرونی موجود در شبکه اندوپلاسمیک سلول میزبان در شکلگیری صحیح ساختار فضایی پروتئین اسپایک کرونا و اپی توپهای فضایی آن نقش بسزایی دارند.
لذا کلیه شرکتهای تولیدی جهان در وهله اول این مهم را رعایت کردهاند. بهنحویکه هم واکسنهای تولیدی بر مبنای پلتفرم mRNA و آدنوویروسها درنهایت در سلول میزبان بیان میشود و میتواند از ساز و کارهای درونسلولی میزبان در تشکیل صحیح ساختار فضایی پروتئین اسپایک کرونا بهره ببرد و هم در پلتفرم واکسن کرونای نوترکیب، کلیه شرکتهای معتبر جهت تولید پروتئین نوترکیب اسپایک کرونا از سلولهای یوکاریوتی بهره بردهاند؛ چراکه در تولید واکسن، فعالیت بیولوژی و شکل صحیح ساختار فضایی پروتئین و اپی توپهای آن بهعنوان ماده مؤثره یک اصل غیرقابلتوجیه و غیرقابلاجتناب است وگرنه کلیه مطالعات مبتدی و پری کلینیکال آن هیچ ارزش علمی نخواهد داشت، چه رسد به اینکه متقاضی انجام فاز بالینی هم باشند.
عموماً پرونده علمی متقاضیان انجام فاز بالینی قبل از اخذ مجوزات بالینی، حتماً توسط کمیته تخصصی که در آن افراد خبره و باتجربه عضوند مورد واکاوی قرار میگیرد و اگر در بک پرونده خطایی در فرمولاسیون یا بهویژه خطایی در تولید تهیه ماده مؤثره آن واکسن وجود داشته باشد فوراً پرونده را رد میکنند و اصلاً به ماهیت آن پرونده و مطالعات انجامگرفته آن ورود نمییابند.
بر اساس این قاعده مهم کلیه شرکتهای داخلی روش صحیح در تولید ماده مؤثره واکسنهای خود را رعایت کردهاند. جز واکسن نورای دانشگاه بقیهالله که از سیستم مبتدی پروکاریوت در تولید گلیکوپروتئین اسپایک کرونا استفاده کرده است. این در صورتی است که سیستم پروکاریوتی (باکتریایی) ماهیتاً قادر به تولید گلیکوپروتئین با ساختار فضایی صحیح نیست.
بر اساس این قاعده مهم کلیه شرکتهای داخلی روش صحیح در تولید ماده مؤثره واکسنهای خود را رعایت کردهاند. جز واکسن نورای دانشگاه بقیهالله که از سیستم مبتدی پروکاریوت در تولید گلیکوپروتئین اسپایک کرونا استفاده کرده است. این در صورتی است که سیستم پروکاریوتی (باکتریایی) ماهیتاً قادر به تولید گلیکوپروتئین با ساختار فضایی صحیح نیست.
ازآنجاییکه حتی تک اپیتوپهای مهم اسپایک کرونا فضایی است که شکلگیری صحیح آن تابع فولدینگ صحیح کل گلیکوپرتئین اسپایک است، بازهم تولید تک اپیتوپ آن در سیستم پروکاریوت مقدور نیست. دیگر اینکه پروتئینهای خارجی در سیستم پروکاریوتی بهصورت اینکلوژن بادی (نامحلول آبگیری شده) درمیآیند که این باعث میشود از فعالیت بیولوژی پروتئین تولیدی نیز بهمراتب کاسته شود.
به همین خاطر است که در فاز اول مطالعات بالینی واکسن نورا از سه دوز با غلطت عجیب ۸۰ تا ۱۲۰ میکروگرم استفادهشده است، تا فعالیت بیولوژی پایین اینگونه پروتئین تولیدی با افزایش بسیار بالای غلظت با سه مرتبه تزریق جبران شود، اما به این مورد مهم و کلیدی توجه نکردهاند که غلظت بالا و تکرار تجویز بیمورد میتواند منجر به تحمل ایمنی شود.
کما اینکه وقتی این غلظت بالا در فاز بالینی لحاظ میشود معنایش این است که همین غلظت بالا به همراه ادجوانت نیز در حیوانات آزمایشگاهی کوچک ازجمله موش و رت و خرگوش تزریقشده است که واقعاً ازنظر علمی قابل توجیه نیست.
این در حالی است که واکسنهای نوترکیب مشابه از پاستور و رازی و سیناژن از غلطت استاندارد ۵ تا نهایتاً ۲۵ میکروگرم در دو دوز تزریقی استفاده کردهاند.
از طرفی، وقتی خبرنگار خبرگزاری میزان در گفتگوی خبری از رئیس دانشگاه علوم پزشکی بقیهالله میپرسد که واکسن نورا مشابه کدام واکسن خارجی است. رئیس دانشگاه بقیهالله باکمی مکث اظهار داشتهاند که واکسن نورا مشابه واکسن «فی جی» است. نام واکسن فی جی برای اولین بار شنیده میشد و در بررسی اینترنتی نیز وجود خارجی نداشت.
متأسفانه در شرایط بحرانی کنونی تنها چیزی که غالب است بیتوجهی بهسلامت مردم و عدم پاسخگو بودن وزارت بهداشت در صدور مجوزات بالینی است.
هر فرد عامی هم اگر نگاهی اجمالی بهعنوان پروژه فاز بالینی واکسن نورا بیندازد، به این سؤال میرسد که: با توجه به اینکه واکسنهای پاستور و سیناژن و رازی و نورا هر چهارتا واکسنهای نوترکیب هستند. چرا باید واکسن نورا سه تزریق با غلظت ۱۲۰ میکروگرم باشد و سایر واکسنهای مشابه دو تزریق با نهایت غلظت ۲۰ تا ۲۵ میکروگرم؟
مضافاً اینکه، فاز اول بالینی معطوف به بررسی عوارض جانبی و حتی اصلاح تیتراسیون دوز واکسن نیز است. پس در فاز اول از ۴ تا ۵ نوع غلظت متفاوت و متناسب از واکسن نیز به داوطلبان تزریق میشود تا بهترین دوز و کم عارضه ترین دوز انتخاب شود.
مضافاً اینکه، فاز اول بالینی معطوف به بررسی عوارض جانبی و حتی اصلاح تیتراسیون دوز واکسن نیز است. پس در فاز اول از ۴ تا ۵ نوع غلظت متفاوت و متناسب از واکسن نیز به داوطلبان تزریق میشود تا بهترین دوز و کم عارضه ترین دوز انتخاب شود.
به بیانی دیگر، فاز اول معطوف به بررسی اولیه ایمنیزایی واکسن نیز تلقی میشود که تجمیع دادهها و ارائه گزارش در این فاز کاری زمانبر است؛ اما رئیس دانشگاه بقیهالله در اقدامی کاملاً غیراصولی، فاز اول واکسن خودشان را آنهم با سه بار تزریق در مدتی کمتر از یک ماه سپری کرده است. این در حالی بوده است که برای واکسن نورا در فاز بالینی اول تزریق سه دوز واکسن به ترتیب در روزهای 1 و 21 و 35 به داوطلبان تزریق شده است.
نکته اینجاست که رئیس دانشگاه بقیهالله در تاریخ نهم مرداد مصاحبهای با خبرنگاران داشته و صراحتاً بیان داشته که تا این تاریخ تزریق اول تمامشده و در حال تزریق دوم هستند که تا آن تاریخ نیمی از تزریق دوم مانده است. اما به ناگاه 11 روز بعد به مورخ بیستم مردادماه پایان موفقیتآمیز فاز اول طی نشستی به خبرنگاران گزارش داده شد تا برای اولین بار رکورد تزریق دوز دوم و سوم واکسن و جمعآوری نتایج و تهیه گزارشها در 11 روز به ثبت برسد.
با توجه به اینکه احترام به قوانین و دستورالعملهای علمی ارزیابی واکسنها بهنوعی احترام و احساس مسئولیت وزارت بهداشت و محققان نسبت بهسلامت جامعه تلقی میشود؛ باید گفت که چنین واکسنی به شرح علمی بالا چطوری طراحی و تولید و نتایج پیش بالینی آن در کمیتههای تخصصی مقبول واقعشده و مجوز فاز بالینی را دریافت نموده است؟
سؤالبرانگیزتر اینکه رئیس دانشگاه علوم پزشکی بقیهالله نیز سرپرست فازهای بالینی واکسن نورا شده که محل اجرای آن نیز بیمارستان بقیهالله است که این یک تعارض منافع آشکار است و گزارشهای آن نیز وفق مقررات نظام سلامت هیچ ارزش استنادی و علمی را ندارد، چراکه بررسیکننده فاز بالینی واکسن باید شخصیت حقیقی و حقوقی کاملاً مستقل و بیطرفی باشد، نه اینکه طراح، تولیدکننده، سرمایهگذار، انجام دهنده فاز پیش بالینی، ناظر و بررسیکننده فاز بالینی واکسن همه در طول هم قرار گیرند.
این تعارض منافع سبب میشود که فاز بالینی مهم اول واکسن نورا بهصورت موفقیتآمیز توسط رئیس دانشگاه بقیهالله در این فرجه زمانی کوتاه و قابلتأمل خلاصه و گزارش شود و جالب اینکه واکسن موردبررسی خودشان را چنان کارا و فاقد کوچکترین عوارض جانبی معرفی مینماید که متقاضی تزریق چنین واکسنی در نوجوانان ۱۲ تا 18 سال از وزارت بهداشت میشود.
لذا رئیس دانشگاه بقیهالله برای تسریع کار و برای اینکه بتواند تا قبل از مهرماه که زمان بازگشایی مدارس است چنین واکسنی را به کودکان تزریق نماید از وزارت بهداشت خواستار صدور مجوز تزریق به کودکان 12 تا 18 سال در فاز بالینی و همچنین ادغام فازهای دوم و سوم بالینی میشود و دکتر زالی نیز آن را تأیید مینماید.
از آنطرف مدیر پروژه واکسن کرونا در زمان اخذ مجوز بالینی اول، طی مصاحبهای به مردم این نوید را داده بود که دانشگاه طی دو تا سه هفته آتی واکسن را تولید و انبار مینماید تا پس از اتمام فاز سوم آن را روانه بازار نماید. این ادعای عامیانه از طرف مجری تولید یک واکسن در صورتی است که فازهای بالینی مطالعات تحقیقی محسوب میشوند که باعث تثبیت و اصلاح فرمولاسیون یک واکسن میشوند و امکانپذیر نیست که از ابتدا تولید انبوه واکسن داشته باشند و بعدازآن شروع به فاز مطالعات بالینی آن واکسن نمایند؟
آنچه مسلم است سیستم تولیدی پروتئین نوترکیب واکسن نورا پروکاریوتی است که مملو از اندوتوکسین است.
حذف کامل اندوتوکسینها از محصولات بیولوژیکی عملاً مقدور نیست و به حداقل یا حد آستانه رساندن آن نیز بسیار هزینهبردار است؛ اما وقتی دوز واکسنی بهصورت غیرمعمول تا ۱۲۰ میکروگرم لحاظ میشود معنایش این است که به همین میزان نیز اندوتوکسین در هر دوز واکسن انباشتهشده که میتواند همراه با تبعات التهاب لوکالی و سیستمی و بعضاً شوک انافیلاکسی همراه باشد.
حال، با این واقعیتهای علمی، سرپرست بالینی این طرح چگونه متقاضی تزریق چنین ترکیبی از واکسن در جوانان کم سن شده است؟
متأسفانه این اقدامات پوپولیستی نسبت بهسلامت مردم در حالی رخ میدهد که رئیس دانشگاه علوم پزشکی بقیهالله پزشک است، یعنی هم خود باید ضامن سلامت مردم باشد و هم بهعنوان رئیس یک دانشگاه، الگوی اخلاقگرایی در تحقیقات و الگویی در اجرای صحیح ترتیبات و دستورالعملهای علمی!
امیدوارم که این گزارش مستدل و علمی سبب شود تا برخی اقدامات و مجوزهایی که بدون پشتوانه علمی است و میتواند سلامت جامعه را با خطر مواجه سازد، مورد بازبینی مجدد قرار گیرد و سرمایهگذاریها در حیطه مهم واکسن در مسیر درست هدایت شود.
*متخصص درزمینهٔ ویروس و واکسن
تصاویر و شرح مستنداتی که در این مقاله به آنها ارجاع داده شده است
لینک کوتاه: کپی لینک
۱۲ آسیب شدید تلفن همراه و فضای مجازی برای کودکان (اینفوگرافیک) «جهانگیز غفاری» بازیگر قبل انقلاب در 83 سالگی و در تهران؛ سال 1402(عکس) گلهای خود را تنها نگذارید؛ لمس گیاهان، سپری طبیعی در برابر استرس نوری وقتی جهان میلرزد، عشق پرفروش میشود رونالدو نبود کسی نام عربستان را هم نشنیده بود!/ حمله تحقیرآمیز ستاره سابق رئال به سعودیها بزرگترین یوتیوبر دنیا یک اپلیکیشن بانکی را تصاحب کرد قتلی که از یک نگاه شروع شد محققان هاروارد: تنوع در ورزش به کاهش بیشتر خطر مرگ زودرس کمک میکند بازیگران زن ایرانی محبوب در جهان عرب چه کسانی هستند؟ جنگنده پنهانکار با سرعت بیشتر و قیمت کمتر (+عکس) «کارواش» هشداردهنده است/ پولشویی در سادهترین شکل اتفاق میافتد از دمشق تا تهران؛ سلاف فواخرجی با دلش به «سرزمین فرشتهها» آمد سدر در طب سنتی چه فوایدی دارد؟ مقصد عوض شد؛ ایلان ماسک بهجای مریخ روی ماه شهر میسازد کارگردان گیس: دغدغه اقتصادی مردم در دل داستان است

.png)


